ユーリー・バンダジェフスキー著
平沼百合 和訳
次に挙げるデータを分析することで、この放射性物質の心血管系に対しての悪影響を評価する事ができる。このデータとは、さまざまな体内の放射性セシウムの取り込みレベルを持つさまざまな年齢の子供たちのECG (心電図)検査であり、チェルノブイリ事故で汚染された区域の住民の臓器の顕微鏡的研究であり、そして最後に、動物を使った研究実験である。この影響は、放射性セシウムの細胞構造に対しての直接的影響だけでなく、体内のシステムを介した間接的影響、特に神経系と内分泌系を通しての間接的影響として現れる。
放射性セシウムの心臓への直接的影響というのは、他の臓器や組織に比べて、心筋細胞に蓄積しやすい事による(図9&10)。多分それは、Na+/K+ポンプの機能が強いためである。すなわち、Cs-137 はカリウムに似ているので、心筋細胞によってかなり簡単に吸収されるのである。このプロセスには、細胞膜の構造が関連しており、放射性セシウムは、その構造と容易に反応する。15 これは、クレアチンホスホキナーゼのような大変重要な酵素の抑制をきたす。クレアチンホスホキナーゼは高エネルギーリン酸の貯蔵、運送と利用を含む細胞のエネルギー代謝に関連している。クレアチンホスホキナーゼは、リン酸基置換を触媒する酵素であり、ATPとクレアチンから、クレアチンリン酸とADPに変換する。1

図9 実験用動物の臓器と全身におけるCs-137の蓄積 1-心臓、2-肝臓、3-脾臓、4-腎臓、5-全身

図10 一日につき180 Bq摂取したアルビノラットの内臓内のCs-137の蓄積
1-全身、2-肝臓、3-腎臓、4-心筋、5-脾臓、6-骨格筋、7-睾丸、8-肺
クレアチンホスホキナーゼは、細胞質、ミトコンドリア、ミクロゾーム、細胞核、筋小胞体膜や筋原線維と言った、様々な細胞内構造に分布している。現在の概念によると、ミトコンドリアのクレアチンホスホキナーゼは、酸化的リン酸化によってミトコンドリアのマトリックス内で産生されるATPからの、クレアチンリン酸の生成を触媒する。このクレアチンリン酸は、濃度勾配に沿って細胞質内に移動するか、急速な浸透によって特定のクレアチンホスホキナーゼのアイソザイムに到達し、特に次のような構造と関係を結ぶ。
ミトコンドリア型クレアチンホスホキナーゼは、ミトコンドリアの外膜と内膜を結合させ、その構造を作る。1
クレアチンホスホキナーゼがM線に局在化する事により、ATPが継続して再生できる状況を作り、筋原線維の適切な収縮作用を確実にする(図11)。結果的に産生されるクレアチンは、再度リン酸化における基質となるために、ミトコンドリアに戻る。

図11 心筋の介在板の構成(模式図)
1-心筋細胞の基底膜、2-心筋細胞膜、3-ミトコンドリア、4-筋原線維、5-筋形質、6-細胞質ネットワーク、7-細いフィラメント(アクチン)、8-太いフィラメント(ミオシン)、9-介在板、10-明帯(I帯)、11-暗帯(A帯)、12-Z線、13-M線、14-デスモゾーム(接着斑)、15-ネクサス(ギャップ結合)、16-接着野。(Bargmann & Schulceより修正)
故に、酵素活性の減少は、心筋細胞のエネルギー複合体における重篤な構造的および代謝的欠陥を示す。これはミトコンドリアの数とサイズの増加、板状クリステの数の増加とその後の破壊として、ミトコンドリアシステムにおける変化として見られる。また、ミトコンドリアの凝集とミトコンドリア間の接触の数の変化としても見られる(図12)。
図12 放射性セシウムを45 Bq/kg取り込んだラットの、心筋細胞のミトコンドリアの凝集、数の増加とサイズの増加 (倍率x30,000)
エネルギー複合体の抑制は、放射性セシウムによる細胞膜の構造への直接的な影響と、いくつかの代謝産物、特にミトコンドリアシステムに有毒効果のある甲状腺ホルモンの影響に関連している可能性がある。13 この点については、グレーヴス病(バセドウ病)や実験的に誘発された甲状腺機能促進症では、クレアチンホスホキナーゼの活性が抑制されることがわかっている。1 放射性セシウムの影響下において、遊離サイロキシン(FT4)の増加がこれらの酵素を抑制する事によって、心筋細胞を損傷する可能性がある。この仮説は、放射性セシウムの取り込みが37 Bq/kg以上である子供達において、血液内の遊離サイロキシンの数値に平行して心電図(ECG)の異常が増加する事によって証明される(図13)。よって、不整脈の発症にはサイロキシンが関与している可能性がある。

図13 子供達の血清中のサイロキシン(T4)のレベルとCs-137取り込み量の相関(グループ1と3の間でP<0.001)
男性では、クレアチンホスホキナーゼの活性は女性よりも大きい。1 放射性セシウムの影響下において、心筋細胞でのこの酵素の脆弱性が男性における突然死の主因である可能性を無視できない。8,29,41
心筋構造におけるアルカリホスファターゼ活性の減少は、心筋変性の進行を意味している。それは電離性放射能への被ばくの特徴である。36
放射性セシウムを投与した実験動物や、放射性セシウムで汚染された地域に住む人達の心筋細胞における構造的変化の特質は、筋小胞体膜の、Ca2+に対する浸透性低下として現れる。これはこの放射性核種の細胞膜に対する直接的影響と同時に、この放射性核種の自然崩壊において放出される放射線のせいでもある。8,29,41 結果として起こるリン脂質の脂肪酸鎖の過酸化は、細胞膜の構造の変化と、Ca2+を含む様々なイオンへの浸透性の変化に繋がる。同時に、当然ながら細胞膜内にある酵素活性にも変化を与える。フリーラジカルの過剰な生成と脂質過酸化の増加は、細胞膜の破壊に貢献する。
心筋の筋小胞体のCa2+輸送システムは、Ca2+を放出したり蓄積する事によって、筋原線維の収縮・弛緩プロセスに活発に関与している。そのシステムが、放射性セシウムを含む様々な因子による損傷を受けると、心筋細胞内遊離Ca2+のレベルが上昇し、筋原線維の弛緩が妨げられる。
筋組織の変化は、筋原線維の複屈折性の変化として観察される。すなわち、区域的および亜区域的収縮、心筋細胞内の筋融解、筋原線維の原発性クラスター変性(注: ロシア圏独特の表現であり、英語圏での「Contraction band necrosis」、日本語で収縮帯壊死に該当すると思われる。)、細胞変性、そして最終的には凝固壊死または融解壊死に至る。32 偏光顕微鏡で観察すると、筋原線維の区域的および亜区域的な収縮変化は、A帯の増強として現れる。これはあたかも横紋筋原線維の横断面のなかに光る筋が入ったように見える。光学顕微鏡で観察すると、これらは密度増強と好酸球増多として観察される。放射性セシウムを10日間取り込んだビスター・ラット(セシウム濃度60-100 Bq/kg)にも同様の変化が見られた(図14)。
図14 食物によって放射性セシウムを取り込んだ動物(体内濃度100 Bq/kg) の心筋の病理組織切片。心筋細胞の筋原線維のびまん性区域的収縮。びまん性筋細胞融解。リンパ組織球の局部的浸潤。ヘマトキシリン-エオジン染色。(倍率x125)
筋原線維の原発性クラスター変性において、無偏光性の領域が偏光性の領域の間に見られる(図15)。これはただの区域的収縮とは異なり、心筋細胞に重篤で不可逆的な損傷があることを示しており、心筋細胞の死を意味している。原発性クラスター変性は、急性心不全においてよく見られるのに留意すべきである。30,31

図15 出産中に死亡した女性の心筋の病理組織切片。心臓内の放射性セシウム濃度105 Bq/kg。筋原線維の原発性クラスター変性。筋線維が粗となっている。筋肉間浮腫。ヘマトキシリン-エオジン染色。(倍率x250)
細胞変性、または心筋細胞の生体内自己融解も不可逆的な障害である。放射性セシウムの影響下では、このような障害がびまん性に見られる(図16、17)。
図16 放射性セシウムの取り込み後(体内濃度900 Bq/kg)の動物の心筋の病理組織切片。びまん性心筋細胞融解。極度の組織間浮腫。ヘマトキシリン-エオジン染色。(倍率x125)
図17 突然死した43歳のドブルシ住民の心筋の病理組織切片。放射性セシウム濃度45 Bq/kg。びまん性心筋細胞融解。筋肉間浮腫。筋線維断片化。ヘマトキシリン-エオジン染色。(倍率x125)
上記の変化は、放射性セシウム被ばくだけでなく、毒物摂取、低酸素症、機能的過負荷14,24,40 や、ストレス反応を引き起こすような、極端な環境因子などによる代謝障害によっても引き起こされる。27,28,31 またこれらの反応は、心筋細胞内Ca2+濃度増加時に見られる。28
カテコールアミン(ノルアドレナリン、アドレナリン)の心筋のβアドレナリン作動性受容体への作用は心筋の損傷メカニズムにおいて主導的役割をもつ。これは心臓の虚血性障害とは全く関係していない。28
心臓への影響の仕組みは、ストレス反応を通して様々な要因に影響されている。高濃度のカテコールアミンは、電位依存性と受容体依存性を持つカルシウムチャネルの開口の数とタイミングを増やし、心筋細胞内のCa2+の蓄積の結果を招く。また、刺激伝導系の細胞はより早い時期に、より大きな損傷を受けている。それは静止膜電位が浅く、活動電位を起こすイオンの流入が主にCa2+であるためである。10 さらにこの刺激伝導系システムは、圧倒的にアドレナリン作動性神経支配を受けている。28
このプロセスの結果、細胞内Ca2+濃度が高くなる。これらのCa2+が不適切に細胞から放出されると、不整脈、すなわち心リズムの乱れが起こり得る。それは陽イオンポンプの機能に直接的に関係している事を我々は強調したい。ポンプのエネルギー供給においての重要な役割は、クレアチンホスホキナーゼと解糖系によって果たされる。28 心筋の弛緩を起こし、細いアクチンと太いミオシンの筋原線維の間のブリッジを壊すには、この2つのシステム両方に関与することが必要である。このシステムには、筋小胞体ATPアーゼも含む。これはCa2+を輸送して筋小胞体の小胞体腔の中に戻す働きを持っている。これはエネルギーを必要とするプロセスであり、心筋のエネルギー消費のほぼ15%を包括すると言う事に留意すべきである。25
汚染区域に住む人々への放射性セシウムの影響の持続期間と大脳半球の細胞内でのノルアドレナリン生成の抑制を考慮すると、23 カテコールアミンの、筋線維の収縮を起こす主導的役割を想像するのは難しくない。それは強いストレス反応があるだけでも起こり得るが実際上、放射性セシウムの影響下における細胞内Ca2+蓄積は、ミトコンドリアと筋小胞体膜を含む細胞膜内のエネルギー供給システムへの損傷による、エネルギー不足によって起こり得る。だから細胞は速やかにCa2+を放出する事ができないのである。Caイオンは大変激しく細胞内に流入する。これは細胞膜のリン脂質がフリーラジカル類によって破壊されているからである。この状況では著しい心筋損傷を起こすのに大した努力は必要でない。この状況では心筋細胞の死は、過労、急性感染症やアルコール中毒などによる、長期のエネルギー不足で起こり得る。
心臓の活動は、体内の放射性セシウムの濃度を上げることによって停止させる事ができる。特に、5日以内に1,000 Bq/kgと言う濃度に達するほどの、大量のCs-137の急な投与は、ラットで心停止を引き起こした。この場合、放射性物質そのものが直接の死因となった。より少ない量では、放射性セシウム蓄積下での心筋細胞の筋原線維の再収縮の原因は、感情的ストレスによってカテコールアミンが放出される事でも有り得る。これは、長期間のセシウム中毒の所見である、すなわち、交感神経系の機能の進行性の抑制が起こり、体が持つ適応への余裕が減るからである。17 同時に、放射性セシウムの影響下での心臓障害における、カテコールアミンの役割を除外する事は不可能でもある。
これは、慢性的胃腸疾患を持つ子供たちの臨床的および実験的テストの結果によって確認されている。自律神経系反応性の交感神経緊張促進頻度と、体内における放射性セシウムの量には直接的に比例する関係があった。上記のデータに基づいて、放射性セシウム取り込み下では、カルシウム輸送システムにおけるエネルギー不足が心臓リズムの乱れ、心筋細胞の収縮装置の障害、そして最終的には心停止へと繋がると言う結論を下さざるを得ない。
心血管系への損傷は、他の臓器やシステム、特に腎臓と別に考察する事はできない。体内からのセシウムの排泄を司る主な臓器として、16 腎臓は、低濃度のCs-137 にさえも著しい影響を受ける。腎臓はまた、心血管系と似た有害な影響を受ける。その最初かつ主要な障害部位は糸球体構造である。6,7 細動脈の平滑筋線維の中で、心筋内で見られるのと全く同じ変化が起こる。筋原線維の区域的収縮が細動脈の長期に持続した痙攣を引き起こし、ネフロンの構造内での血行を止める。糸球体細胞成分の死は、糸球体内で特徴的構造的変化を形成するが、これは溶けた氷柱と呼ばれる現象である。変性と壊死的な変化が徐々に現れ、糸球体が収縮し断裂する(図18と19)。
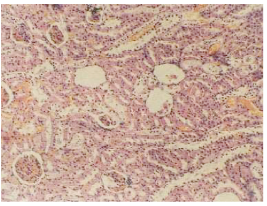
図18 全身の放射性セシウム濃度が900 Bq/kgのアルビノラットの腎臓の病理組織切片。糸球体の壊死と断裂と空洞形成。尿細管上皮の壊死と、硝子滴変性。ヘマトキシリン・エオジン染色。(倍率x125)

図19 ゴメリの71歳の女性患者Aの腎臓の病理組織切片。彼女の死因は腹腔の癒着と、無気肺と膿胸を伴う右肺の急性大葉性肺炎であり、両側肺浮腫を伴っていた。腎臓内での放射性セシウム濃度は300 Bq/kgだった。糸球体内の空洞での液体蓄積。尿細管上皮の硝子滴変性と水腫変性。間質組織の浮腫。ヘマトキシリン・エオジン染色。(倍率x125)
著しい細胞反応が無い空洞形成は、放射性セシウムの腎臓組織への影響としては典型的である。細動脈内での筋線維の過剰な収縮を起こす能力があるため、放射性セシウムは、腎臓内の血管の微小循環系のプロセスに損傷を与える。また、腎臓と諸臓器における損傷への反応として体内でなくてはならない炎症反応が欠損している事に留意すべきである。我々の意見としては、これは特殊な細胞内での、炎症伝達物質のような生理活性物質の合成が抑制されるためである。
損傷を受けた糸球体は機能停止する。放射性セシウムの影響下にある腎臓の病理学的特徴は、血栓性微小血管症の特徴と同じである。2 これは偶然ではない。どちらの場合でも、ネフロンの微小循環系の血流システムが細血管のレベルで途絶され、壊死プロセスを引き起こす。
腎不全の進行により、体内での代謝老廃物が蓄積する。これらは、放射性セシウム自体の毒性影響に加えて、生命維持に必要な諸臓器と諸システムに有毒な影響を持つ。また特徴的であるのは、特に心膜(図20)や胸膜(図21)などの、奨膜における炎症プロセスである。
図20 体内に900 Bq/kgのCs-137を取り込んだ動物の心筋の病理組織切片。心外膜と心嚢の好中球とリンパ球による浸潤。著しい心筋細胞融解。ヘマトキシリン・エオジン染色。(倍率x125)

図21 体内900 Bq/kgのCs-137を取り込んだ動物の肺の病理組織切片。肺胞腔内の血管の破裂による出血。臓側胸膜の好中球、リンパ球、組織球による浸潤。ヘマトキシリン・エオジン染色。(倍率x125)
腎臓の血管系への損傷は、血圧、特に子供においての拡張期血圧の上昇の主な理由のひとつかもしれない。しかし、この病理的プロセスは隠れて潜在的に進行するため、普通の医療が不十分であったと証明された後でしか、はっきりと現れないかもしれない。従って、放射性セシウムで汚染された地域に住む子供たちには、近代的な検査室と臨床検査の診断方法を用いた、定期的な腎臓と心臓の機能の評価を行わなければいけない。
肝臓もまた、放射性セシウムの作用による悪影響を受ける。ゴメリ地方に住んでいた人々は、著しい量の放射性セシウムが肝臓にあった。6 これらのほとんどのケースでは、病理学的検査は、肝細胞内で顕著な変性と壊死変化を明らかにした(図22)。
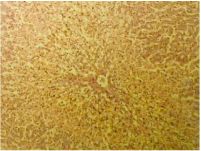
図22 突然死した40歳のゴメリ住民の肝臓の病理組織切片。肝臓内の放射性セシウム濃度は142 Bq/kgだった。脂肪と蛋白質の変性と肝細胞の壊死。ヘマトキシリン・エオジン染色。(倍率x125)
同様の変化は、放射性セシウムの影響下にある実験用動物でも見られた。直ちに、肝細胞の機能、特に合成機能と解毒作用が障害された。
肝細胞の合成機能の障害は、体内での放射性セシウムの濃度が増加するにつれて、L1-グロブリンとL2‐グロブリン(注: 日本語ではα1グロブリンとα2グロブリンに該当すると思われる。)の合成の進行的な減少として現れる。これは間違いなく、心臓を含む他の臓器における代謝状態に影響を与えるだろう。
ステロイドホルモン、特に副腎皮質ホルモンの酸化が肝臓内で行われる。また、副腎髄質ホルモンであるカテコールアミンのノルアドレナリンとアドレナリンの分解が、メチル化反応を通して行われる。肝臓の大きな役目はアンモニアの解毒であり、それは尿素の合成に使う事により行われる。合成機能と解毒作用両方の非効率性は、代謝障害の出現に繋がり、心筋の状態に有害な影響をもたらす。
故に、放射性セシウムを取り込んでいる体内で起こっている代謝障害は、心筋細胞の構造と機能の乱れに寄与するかもしれない。
結論
この本を書きながら、私は文明人全てに体内に取り込まれた放射性物質の危険性を知らせる必要性を考え続けた。残念ながら、この問題に関しての現代社会の姿勢は、いくら良く見ても、無関心である。私達は、このために、人命という形の非常に高い代償を払うのである。知的な無知というのは、悲劇に繋がる。大部分の責任は医学科学者にある。既に入手していたデータを使って人々に情報を与えようとしなかったばかりではなく、放射性核種の取り込みによる体内での有害な変化を研究もしなかった。
私は、この小さな本が既存の問題についての情報不足を埋め合わせる事ができないのを認識している。しかしながら、いくらかの関心を高め、問題の議論に繋がる事を望む。これは間違いなく有益であろう。
提示された情報に基づいて、いくつかの結論を下すことができる。
私達が望んでいるかいないかに関わらず、放射性核種、特に放射性セシウムは、私達の環境に存在している。何も防御対策を取らなければ、主に食べ物と水から人体に入り、臓器や組織に取り込まれる。人命にとっての最大の危険は、成長しつつある人体の心筋による放射性セシウムの取り込みである。
心筋細胞に放射性核種のCs-137が入り込むと、構造的、そして代謝的変化が起こり、エネルギー不足と、心筋細胞の主な機能の阻害を誘発し、死に至るケースもある。 心筋の直接的損傷と、その活動を調整する諸臓器と諸システムへの損傷を示す、一連の変化が起こる。心筋細胞は、放射性セシウムによる直接的な損傷だけでなく、自然な代謝物からも、その産生、輸送、結合、排泄と分解の阻害によって、損傷を受ける(図23)。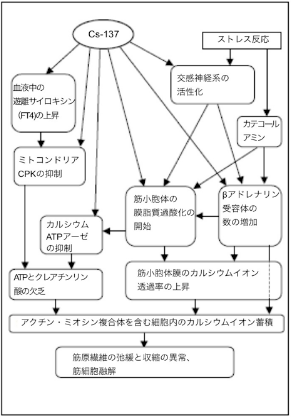
図23 放射性セシウムの心筋細胞への影響(CPK=クレアチンホスホキナーゼ、ATP=アデノシン三リン)
病理的変化の強度は、体内と心筋の中の放射性セシウムの量に直接的に依存する。長期間に渡る放射性セシウムの体内への取り込みが30 Bq/kgを超えるのは非常に望ましくなく、重篤な結果がもたらされる可能性がある。
ほとんどの場合、体内の放射性セシウムの量が10-20 Bq/kgであると、死に至る事はない。しかし、放射性セシウムの心筋細胞のエネルギー器官への影響により、心筋細胞の適応能力が著しく減少する。身体的や精神的ストレス、低酸素症、極度の温度変化、飲酒、感染症やアレルギー疾患などの、様々なストレスがある状況や普通の状況下において機能する事が不可能になるかもしれない。
放射性セシウムは、強力な損傷物質であると言う認識が必要であり、細胞活動にとっての遅延性の毒として扱われるべきである。心筋細胞のエネルギー代謝を妨げ、心筋症の原因となる。その特等は心拍リズムの乱れ、心筋収縮力の異常と、末梢血管の痙攣である。取り込まれた放射性セシウムの人間や動物に対しての影響は、放射能源としてでなく、主に化学元素としてのエネルギープロセスと代謝プロセスへの関わりを示唆する事に留意すべきである。しかしながら、放射能源としての関与は、完全に除外する事ができない。これは特に、放射性セシウムの長期の低線量被ばくにおいて顕著である。放射性セシウムの影響による腎臓での病理学的変化の主な理由は、細動脈の痙攣であり、これが糸球体ループの壊死とネフロン構造の破壊を引き起こす。セシウムの血管収縮作用は1888年にS.S. Botkinによって記録されている。11
故に、放射性セシウムは、放射能汚染区域に住む子供達における高血圧の主要な病因因子のひとつなのである。これは、多数の観察によって確認されている。20
チェルノブイリ事故に影響を受けた地域に住む人口における、心血管疾患の予防の原理として適切な点は、放射性物質、何よりも放射性セシウムの減少を含むが、これは食物内での含有量の減少と体内からの吸着剤による排泄によるものである。こういった対策は、心筋の代謝を改善するのに重要な役割を果たすであろう。
ダウンロードPDF https://docs.google.com/file/d/0B68f83tqq7QuV3ZFaUxHQWcxNlU/edit?usp=sharing
セブンイレブン・セブンプリント 予約番号 49703935
平沼百合 和訳
次に挙げるデータを分析することで、この放射性物質の心血管系に対しての悪影響を評価する事ができる。このデータとは、さまざまな体内の放射性セシウムの取り込みレベルを持つさまざまな年齢の子供たちのECG (心電図)検査であり、チェルノブイリ事故で汚染された区域の住民の臓器の顕微鏡的研究であり、そして最後に、動物を使った研究実験である。この影響は、放射性セシウムの細胞構造に対しての直接的影響だけでなく、体内のシステムを介した間接的影響、特に神経系と内分泌系を通しての間接的影響として現れる。
放射性セシウムの心臓への直接的影響というのは、他の臓器や組織に比べて、心筋細胞に蓄積しやすい事による(図9&10)。多分それは、Na+/K+ポンプの機能が強いためである。すなわち、Cs-137 はカリウムに似ているので、心筋細胞によってかなり簡単に吸収されるのである。このプロセスには、細胞膜の構造が関連しており、放射性セシウムは、その構造と容易に反応する。15 これは、クレアチンホスホキナーゼのような大変重要な酵素の抑制をきたす。クレアチンホスホキナーゼは高エネルギーリン酸の貯蔵、運送と利用を含む細胞のエネルギー代謝に関連している。クレアチンホスホキナーゼは、リン酸基置換を触媒する酵素であり、ATPとクレアチンから、クレアチンリン酸とADPに変換する。1
図9 実験用動物の臓器と全身におけるCs-137の蓄積 1-心臓、2-肝臓、3-脾臓、4-腎臓、5-全身
図10 一日につき180 Bq摂取したアルビノラットの内臓内のCs-137の蓄積
1-全身、2-肝臓、3-腎臓、4-心筋、5-脾臓、6-骨格筋、7-睾丸、8-肺
クレアチンホスホキナーゼは、細胞質、ミトコンドリア、ミクロゾーム、細胞核、筋小胞体膜や筋原線維と言った、様々な細胞内構造に分布している。現在の概念によると、ミトコンドリアのクレアチンホスホキナーゼは、酸化的リン酸化によってミトコンドリアのマトリックス内で産生されるATPからの、クレアチンリン酸の生成を触媒する。このクレアチンリン酸は、濃度勾配に沿って細胞質内に移動するか、急速な浸透によって特定のクレアチンホスホキナーゼのアイソザイムに到達し、特に次のような構造と関係を結ぶ。
- 筋肉収縮に関与する構造である、筋原線維のM 線
- 筋小胞体膜のCa2+ATPアーゼ
- 筋形質とNa+/K+ATPアーゼ
- アセチルコリン受容体とATPアーゼが豊富な シナプス後膜
ミトコンドリア型クレアチンホスホキナーゼは、ミトコンドリアの外膜と内膜を結合させ、その構造を作る。1
クレアチンホスホキナーゼがM線に局在化する事により、ATPが継続して再生できる状況を作り、筋原線維の適切な収縮作用を確実にする(図11)。結果的に産生されるクレアチンは、再度リン酸化における基質となるために、ミトコンドリアに戻る。
図11 心筋の介在板の構成(模式図)
1-心筋細胞の基底膜、2-心筋細胞膜、3-ミトコンドリア、4-筋原線維、5-筋形質、6-細胞質ネットワーク、7-細いフィラメント(アクチン)、8-太いフィラメント(ミオシン)、9-介在板、10-明帯(I帯)、11-暗帯(A帯)、12-Z線、13-M線、14-デスモゾーム(接着斑)、15-ネクサス(ギャップ結合)、16-接着野。(Bargmann & Schulceより修正)
故に、酵素活性の減少は、心筋細胞のエネルギー複合体における重篤な構造的および代謝的欠陥を示す。これはミトコンドリアの数とサイズの増加、板状クリステの数の増加とその後の破壊として、ミトコンドリアシステムにおける変化として見られる。また、ミトコンドリアの凝集とミトコンドリア間の接触の数の変化としても見られる(図12)。
図12 放射性セシウムを45 Bq/kg取り込んだラットの、心筋細胞のミトコンドリアの凝集、数の増加とサイズの増加 (倍率x30,000)
エネルギー複合体の抑制は、放射性セシウムによる細胞膜の構造への直接的な影響と、いくつかの代謝産物、特にミトコンドリアシステムに有毒効果のある甲状腺ホルモンの影響に関連している可能性がある。13 この点については、グレーヴス病(バセドウ病)や実験的に誘発された甲状腺機能促進症では、クレアチンホスホキナーゼの活性が抑制されることがわかっている。1 放射性セシウムの影響下において、遊離サイロキシン(FT4)の増加がこれらの酵素を抑制する事によって、心筋細胞を損傷する可能性がある。この仮説は、放射性セシウムの取り込みが37 Bq/kg以上である子供達において、血液内の遊離サイロキシンの数値に平行して心電図(ECG)の異常が増加する事によって証明される(図13)。よって、不整脈の発症にはサイロキシンが関与している可能性がある。
図13 子供達の血清中のサイロキシン(T4)のレベルとCs-137取り込み量の相関(グループ1と3の間でP<0.001)
男性では、クレアチンホスホキナーゼの活性は女性よりも大きい。1 放射性セシウムの影響下において、心筋細胞でのこの酵素の脆弱性が男性における突然死の主因である可能性を無視できない。8,29,41
心筋構造におけるアルカリホスファターゼ活性の減少は、心筋変性の進行を意味している。それは電離性放射能への被ばくの特徴である。36
放射性セシウムを投与した実験動物や、放射性セシウムで汚染された地域に住む人達の心筋細胞における構造的変化の特質は、筋小胞体膜の、Ca2+に対する浸透性低下として現れる。これはこの放射性核種の細胞膜に対する直接的影響と同時に、この放射性核種の自然崩壊において放出される放射線のせいでもある。8,29,41 結果として起こるリン脂質の脂肪酸鎖の過酸化は、細胞膜の構造の変化と、Ca2+を含む様々なイオンへの浸透性の変化に繋がる。同時に、当然ながら細胞膜内にある酵素活性にも変化を与える。フリーラジカルの過剰な生成と脂質過酸化の増加は、細胞膜の破壊に貢献する。
心筋の筋小胞体のCa2+輸送システムは、Ca2+を放出したり蓄積する事によって、筋原線維の収縮・弛緩プロセスに活発に関与している。そのシステムが、放射性セシウムを含む様々な因子による損傷を受けると、心筋細胞内遊離Ca2+のレベルが上昇し、筋原線維の弛緩が妨げられる。
筋組織の変化は、筋原線維の複屈折性の変化として観察される。すなわち、区域的および亜区域的収縮、心筋細胞内の筋融解、筋原線維の原発性クラスター変性(注: ロシア圏独特の表現であり、英語圏での「Contraction band necrosis」、日本語で収縮帯壊死に該当すると思われる。)、細胞変性、そして最終的には凝固壊死または融解壊死に至る。32 偏光顕微鏡で観察すると、筋原線維の区域的および亜区域的な収縮変化は、A帯の増強として現れる。これはあたかも横紋筋原線維の横断面のなかに光る筋が入ったように見える。光学顕微鏡で観察すると、これらは密度増強と好酸球増多として観察される。放射性セシウムを10日間取り込んだビスター・ラット(セシウム濃度60-100 Bq/kg)にも同様の変化が見られた(図14)。
図14 食物によって放射性セシウムを取り込んだ動物(体内濃度100 Bq/kg) の心筋の病理組織切片。心筋細胞の筋原線維のびまん性区域的収縮。びまん性筋細胞融解。リンパ組織球の局部的浸潤。ヘマトキシリン-エオジン染色。(倍率x125)
筋原線維の原発性クラスター変性において、無偏光性の領域が偏光性の領域の間に見られる(図15)。これはただの区域的収縮とは異なり、心筋細胞に重篤で不可逆的な損傷があることを示しており、心筋細胞の死を意味している。原発性クラスター変性は、急性心不全においてよく見られるのに留意すべきである。30,31
図15 出産中に死亡した女性の心筋の病理組織切片。心臓内の放射性セシウム濃度105 Bq/kg。筋原線維の原発性クラスター変性。筋線維が粗となっている。筋肉間浮腫。ヘマトキシリン-エオジン染色。(倍率x250)
細胞変性、または心筋細胞の生体内自己融解も不可逆的な障害である。放射性セシウムの影響下では、このような障害がびまん性に見られる(図16、17)。
図16 放射性セシウムの取り込み後(体内濃度900 Bq/kg)の動物の心筋の病理組織切片。びまん性心筋細胞融解。極度の組織間浮腫。ヘマトキシリン-エオジン染色。(倍率x125)
図17 突然死した43歳のドブルシ住民の心筋の病理組織切片。放射性セシウム濃度45 Bq/kg。びまん性心筋細胞融解。筋肉間浮腫。筋線維断片化。ヘマトキシリン-エオジン染色。(倍率x125)
上記の変化は、放射性セシウム被ばくだけでなく、毒物摂取、低酸素症、機能的過負荷14,24,40 や、ストレス反応を引き起こすような、極端な環境因子などによる代謝障害によっても引き起こされる。27,28,31 またこれらの反応は、心筋細胞内Ca2+濃度増加時に見られる。28
カテコールアミン(ノルアドレナリン、アドレナリン)の心筋のβアドレナリン作動性受容体への作用は心筋の損傷メカニズムにおいて主導的役割をもつ。これは心臓の虚血性障害とは全く関係していない。28
心臓への影響の仕組みは、ストレス反応を通して様々な要因に影響されている。高濃度のカテコールアミンは、電位依存性と受容体依存性を持つカルシウムチャネルの開口の数とタイミングを増やし、心筋細胞内のCa2+の蓄積の結果を招く。また、刺激伝導系の細胞はより早い時期に、より大きな損傷を受けている。それは静止膜電位が浅く、活動電位を起こすイオンの流入が主にCa2+であるためである。10 さらにこの刺激伝導系システムは、圧倒的にアドレナリン作動性神経支配を受けている。28
このプロセスの結果、細胞内Ca2+濃度が高くなる。これらのCa2+が不適切に細胞から放出されると、不整脈、すなわち心リズムの乱れが起こり得る。それは陽イオンポンプの機能に直接的に関係している事を我々は強調したい。ポンプのエネルギー供給においての重要な役割は、クレアチンホスホキナーゼと解糖系によって果たされる。28 心筋の弛緩を起こし、細いアクチンと太いミオシンの筋原線維の間のブリッジを壊すには、この2つのシステム両方に関与することが必要である。このシステムには、筋小胞体ATPアーゼも含む。これはCa2+を輸送して筋小胞体の小胞体腔の中に戻す働きを持っている。これはエネルギーを必要とするプロセスであり、心筋のエネルギー消費のほぼ15%を包括すると言う事に留意すべきである。25
汚染区域に住む人々への放射性セシウムの影響の持続期間と大脳半球の細胞内でのノルアドレナリン生成の抑制を考慮すると、23 カテコールアミンの、筋線維の収縮を起こす主導的役割を想像するのは難しくない。それは強いストレス反応があるだけでも起こり得るが実際上、放射性セシウムの影響下における細胞内Ca2+蓄積は、ミトコンドリアと筋小胞体膜を含む細胞膜内のエネルギー供給システムへの損傷による、エネルギー不足によって起こり得る。だから細胞は速やかにCa2+を放出する事ができないのである。Caイオンは大変激しく細胞内に流入する。これは細胞膜のリン脂質がフリーラジカル類によって破壊されているからである。この状況では著しい心筋損傷を起こすのに大した努力は必要でない。この状況では心筋細胞の死は、過労、急性感染症やアルコール中毒などによる、長期のエネルギー不足で起こり得る。
心臓の活動は、体内の放射性セシウムの濃度を上げることによって停止させる事ができる。特に、5日以内に1,000 Bq/kgと言う濃度に達するほどの、大量のCs-137の急な投与は、ラットで心停止を引き起こした。この場合、放射性物質そのものが直接の死因となった。より少ない量では、放射性セシウム蓄積下での心筋細胞の筋原線維の再収縮の原因は、感情的ストレスによってカテコールアミンが放出される事でも有り得る。これは、長期間のセシウム中毒の所見である、すなわち、交感神経系の機能の進行性の抑制が起こり、体が持つ適応への余裕が減るからである。17 同時に、放射性セシウムの影響下での心臓障害における、カテコールアミンの役割を除外する事は不可能でもある。
これは、慢性的胃腸疾患を持つ子供たちの臨床的および実験的テストの結果によって確認されている。自律神経系反応性の交感神経緊張促進頻度と、体内における放射性セシウムの量には直接的に比例する関係があった。上記のデータに基づいて、放射性セシウム取り込み下では、カルシウム輸送システムにおけるエネルギー不足が心臓リズムの乱れ、心筋細胞の収縮装置の障害、そして最終的には心停止へと繋がると言う結論を下さざるを得ない。
心血管系への損傷は、他の臓器やシステム、特に腎臓と別に考察する事はできない。体内からのセシウムの排泄を司る主な臓器として、16 腎臓は、低濃度のCs-137 にさえも著しい影響を受ける。腎臓はまた、心血管系と似た有害な影響を受ける。その最初かつ主要な障害部位は糸球体構造である。6,7 細動脈の平滑筋線維の中で、心筋内で見られるのと全く同じ変化が起こる。筋原線維の区域的収縮が細動脈の長期に持続した痙攣を引き起こし、ネフロンの構造内での血行を止める。糸球体細胞成分の死は、糸球体内で特徴的構造的変化を形成するが、これは溶けた氷柱と呼ばれる現象である。変性と壊死的な変化が徐々に現れ、糸球体が収縮し断裂する(図18と19)。
図18 全身の放射性セシウム濃度が900 Bq/kgのアルビノラットの腎臓の病理組織切片。糸球体の壊死と断裂と空洞形成。尿細管上皮の壊死と、硝子滴変性。ヘマトキシリン・エオジン染色。(倍率x125)
図19 ゴメリの71歳の女性患者Aの腎臓の病理組織切片。彼女の死因は腹腔の癒着と、無気肺と膿胸を伴う右肺の急性大葉性肺炎であり、両側肺浮腫を伴っていた。腎臓内での放射性セシウム濃度は300 Bq/kgだった。糸球体内の空洞での液体蓄積。尿細管上皮の硝子滴変性と水腫変性。間質組織の浮腫。ヘマトキシリン・エオジン染色。(倍率x125)
著しい細胞反応が無い空洞形成は、放射性セシウムの腎臓組織への影響としては典型的である。細動脈内での筋線維の過剰な収縮を起こす能力があるため、放射性セシウムは、腎臓内の血管の微小循環系のプロセスに損傷を与える。また、腎臓と諸臓器における損傷への反応として体内でなくてはならない炎症反応が欠損している事に留意すべきである。我々の意見としては、これは特殊な細胞内での、炎症伝達物質のような生理活性物質の合成が抑制されるためである。
損傷を受けた糸球体は機能停止する。放射性セシウムの影響下にある腎臓の病理学的特徴は、血栓性微小血管症の特徴と同じである。2 これは偶然ではない。どちらの場合でも、ネフロンの微小循環系の血流システムが細血管のレベルで途絶され、壊死プロセスを引き起こす。
腎不全の進行により、体内での代謝老廃物が蓄積する。これらは、放射性セシウム自体の毒性影響に加えて、生命維持に必要な諸臓器と諸システムに有毒な影響を持つ。また特徴的であるのは、特に心膜(図20)や胸膜(図21)などの、奨膜における炎症プロセスである。
図20 体内に900 Bq/kgのCs-137を取り込んだ動物の心筋の病理組織切片。心外膜と心嚢の好中球とリンパ球による浸潤。著しい心筋細胞融解。ヘマトキシリン・エオジン染色。(倍率x125)
図21 体内900 Bq/kgのCs-137を取り込んだ動物の肺の病理組織切片。肺胞腔内の血管の破裂による出血。臓側胸膜の好中球、リンパ球、組織球による浸潤。ヘマトキシリン・エオジン染色。(倍率x125)
腎臓の血管系への損傷は、血圧、特に子供においての拡張期血圧の上昇の主な理由のひとつかもしれない。しかし、この病理的プロセスは隠れて潜在的に進行するため、普通の医療が不十分であったと証明された後でしか、はっきりと現れないかもしれない。従って、放射性セシウムで汚染された地域に住む子供たちには、近代的な検査室と臨床検査の診断方法を用いた、定期的な腎臓と心臓の機能の評価を行わなければいけない。
肝臓もまた、放射性セシウムの作用による悪影響を受ける。ゴメリ地方に住んでいた人々は、著しい量の放射性セシウムが肝臓にあった。6 これらのほとんどのケースでは、病理学的検査は、肝細胞内で顕著な変性と壊死変化を明らかにした(図22)。
図22 突然死した40歳のゴメリ住民の肝臓の病理組織切片。肝臓内の放射性セシウム濃度は142 Bq/kgだった。脂肪と蛋白質の変性と肝細胞の壊死。ヘマトキシリン・エオジン染色。(倍率x125)
同様の変化は、放射性セシウムの影響下にある実験用動物でも見られた。直ちに、肝細胞の機能、特に合成機能と解毒作用が障害された。
肝細胞の合成機能の障害は、体内での放射性セシウムの濃度が増加するにつれて、L1-グロブリンとL2‐グロブリン(注: 日本語ではα1グロブリンとα2グロブリンに該当すると思われる。)の合成の進行的な減少として現れる。これは間違いなく、心臓を含む他の臓器における代謝状態に影響を与えるだろう。
ステロイドホルモン、特に副腎皮質ホルモンの酸化が肝臓内で行われる。また、副腎髄質ホルモンであるカテコールアミンのノルアドレナリンとアドレナリンの分解が、メチル化反応を通して行われる。肝臓の大きな役目はアンモニアの解毒であり、それは尿素の合成に使う事により行われる。合成機能と解毒作用両方の非効率性は、代謝障害の出現に繋がり、心筋の状態に有害な影響をもたらす。
故に、放射性セシウムを取り込んでいる体内で起こっている代謝障害は、心筋細胞の構造と機能の乱れに寄与するかもしれない。
結論
この本を書きながら、私は文明人全てに体内に取り込まれた放射性物質の危険性を知らせる必要性を考え続けた。残念ながら、この問題に関しての現代社会の姿勢は、いくら良く見ても、無関心である。私達は、このために、人命という形の非常に高い代償を払うのである。知的な無知というのは、悲劇に繋がる。大部分の責任は医学科学者にある。既に入手していたデータを使って人々に情報を与えようとしなかったばかりではなく、放射性核種の取り込みによる体内での有害な変化を研究もしなかった。
私は、この小さな本が既存の問題についての情報不足を埋め合わせる事ができないのを認識している。しかしながら、いくらかの関心を高め、問題の議論に繋がる事を望む。これは間違いなく有益であろう。
提示された情報に基づいて、いくつかの結論を下すことができる。
私達が望んでいるかいないかに関わらず、放射性核種、特に放射性セシウムは、私達の環境に存在している。何も防御対策を取らなければ、主に食べ物と水から人体に入り、臓器や組織に取り込まれる。人命にとっての最大の危険は、成長しつつある人体の心筋による放射性セシウムの取り込みである。
心筋細胞に放射性核種のCs-137が入り込むと、構造的、そして代謝的変化が起こり、エネルギー不足と、心筋細胞の主な機能の阻害を誘発し、死に至るケースもある。 心筋の直接的損傷と、その活動を調整する諸臓器と諸システムへの損傷を示す、一連の変化が起こる。心筋細胞は、放射性セシウムによる直接的な損傷だけでなく、自然な代謝物からも、その産生、輸送、結合、排泄と分解の阻害によって、損傷を受ける(図23)。
図23 放射性セシウムの心筋細胞への影響(CPK=クレアチンホスホキナーゼ、ATP=アデノシン三リン)
病理的変化の強度は、体内と心筋の中の放射性セシウムの量に直接的に依存する。長期間に渡る放射性セシウムの体内への取り込みが30 Bq/kgを超えるのは非常に望ましくなく、重篤な結果がもたらされる可能性がある。
ほとんどの場合、体内の放射性セシウムの量が10-20 Bq/kgであると、死に至る事はない。しかし、放射性セシウムの心筋細胞のエネルギー器官への影響により、心筋細胞の適応能力が著しく減少する。身体的や精神的ストレス、低酸素症、極度の温度変化、飲酒、感染症やアレルギー疾患などの、様々なストレスがある状況や普通の状況下において機能する事が不可能になるかもしれない。
放射性セシウムは、強力な損傷物質であると言う認識が必要であり、細胞活動にとっての遅延性の毒として扱われるべきである。心筋細胞のエネルギー代謝を妨げ、心筋症の原因となる。その特等は心拍リズムの乱れ、心筋収縮力の異常と、末梢血管の痙攣である。取り込まれた放射性セシウムの人間や動物に対しての影響は、放射能源としてでなく、主に化学元素としてのエネルギープロセスと代謝プロセスへの関わりを示唆する事に留意すべきである。しかしながら、放射能源としての関与は、完全に除外する事ができない。これは特に、放射性セシウムの長期の低線量被ばくにおいて顕著である。放射性セシウムの影響による腎臓での病理学的変化の主な理由は、細動脈の痙攣であり、これが糸球体ループの壊死とネフロン構造の破壊を引き起こす。セシウムの血管収縮作用は1888年にS.S. Botkinによって記録されている。11
故に、放射性セシウムは、放射能汚染区域に住む子供達における高血圧の主要な病因因子のひとつなのである。これは、多数の観察によって確認されている。20
チェルノブイリ事故に影響を受けた地域に住む人口における、心血管疾患の予防の原理として適切な点は、放射性物質、何よりも放射性セシウムの減少を含むが、これは食物内での含有量の減少と体内からの吸着剤による排泄によるものである。こういった対策は、心筋の代謝を改善するのに重要な役割を果たすであろう。
ダウンロードPDF https://docs.google.com/file/d/0B68f83tqq7QuV3ZFaUxHQWcxNlU/edit?usp=sharing
セブンイレブン・セブンプリント 予約番号 49703935

0 件のコメント:
コメントを投稿